Autor dr n. wet. Joanna Zarzyńska
Redaktor naczelna magazynu „ZooBranża”
Gdy bierzemy na kolana naszego ukochanego psa i głaskamy jego futro, często nie zdajemy sobie sprawy, że w jego przewodzie pokarmowym, a dokładnie w jelitach, trwa właśnie niekończąca się wojna dobra ze złem. Patogenne drobnoustroje nieustannie dostające się wraz z pobieranym pokarmem ścierają się z dobrymi bakteriami tworzącymi mikrobiom jelitowy i budującymi naturalną odporność organizmu. Praktycznie to tylko dzięki nim nasz pupil nie choruje i może w pełni rozkoszować się urokami życia. Czy możemy wspomóc owych niewidzialnych pomocników zamieszkujących jego przewód pokarmowy i sprawić, że będą funkcjonować jeszcze sprawniej?
Zastanawiamy się, czy istnieje życie na Marsie… Na pewno nie powinniśmy mieć jednak tego dylematu w odniesieniu do wnętrza ciała, ludzkiego czy zwierzęcego – jelita kolonizują drobnoustroje, które mogą osiągać masę nawet 2-2,5 kg, stanowić 95% komórek układu pokarmowego – jeden z niezwykłych i najbardziej zróżnicowanych mikroekosystemów, którego równowaga może wpływać na wiele funkcji organizmu (w tym metabolicznych – otyłość) oraz wiele jednostek chorobowych (nie tylko jelit, lecz także depresji, cukrzycy, chorób nowotworowych). Manipulacja składem mikrobioty może być ważnym narzędziem w profilaktyce i leczeniu ludzi oraz zwierząt towarzyszących.
Co mieszka w brzuszku?
W ludzkim jelicie wykryto obecność ponad 50 gromad bakterii, jednak ekosystem zdominowały w szczególności dwie gromady: Bacteroidetes (z przewagą rodzaju Clostridium, odgrywającego ochronną rolę wobec nabłonka okrężnicy) oraz Firmicutes. W jelicie cienkim występują głównie bakterie względnie beztlenowe i beztlenowe (np. Lactobacillus spp. czy Enterococcus, Staphylococcus, Bifidobacterium), a w okrężnicy dominują bezwzględne beztlenowce (Bacteroidetes, Eubacterium, Bifidobacterium, Clostridium, Fusobacterium).
Mikrobiota kształtuje się od momentu narodzin. Co ważne, w pierwszych dniach życia w przewodzie pokarmowym panują warunki względnie beztlenowe, a co za tym idzie – kolonizowany jest on przez bakterie wykorzystujące tlen ze środowiska, głównie Escherichia coli i E. feacalis, które – zużywając tlen – powodują, że środowisko staje się beztlenowe, czyli sprzyjające zasiedlaniu przez bakterie z rodzaju Bacteroides, Bifidobacterium i Clostridium. Beztlenowce przewyższają prawie 100-krotnie liczbę bakterii fakultatywnie tlenowych.
U człowieka ocenia się, że proces tworzenia indywidualnej mikrobioty jelitowej kształtuje się około drugiego roku życia (u psów około pierwszego roku życia; co ciekawe, u miotowego rodzeństwa w dorosłym życiu wykazywano bardzo zbliżony mikrobiom). Choć oczywiście później, jak już wspominaliśmy w poprzednim artykule o mikrobiomie, status mikrobiomu jest dynamiczny (wpływ wieku, diety, stresów, antybiotykoterapii itd.). U osób starszych zauważalne jest zmniejszenie liczby Bacteroides oraz Bifidobacteria, czyli spadek Bacteroidetes w stosunku do Firmicutes. Mikrobiom starzejących się psów nie był jeszcze badany.
U psa w jelicie cienkim stwierdzono 102-105 jtk/g treści (w niektórych badaniach nawet 109), natomiast w okrężnicy 108-1011 jtk/g. Koty w dwunastnicy posiadają znacznie wyższą liczbę bakterii niż psy. W jelicie cienkim występują głównie bakterie względnie beztlenowe i beztlenowe, a w okrężnicy dominują bezwzględne beztlenowce. 99% bioty jelitowej psów i kotów stanowią: Firmicutes, Bacteroidetes, Proteobacteria, Fusobacteria. W żołądku stwierdzane są Helicobacter spp., Actionobacillus i Streptococcus spp. (u ludzi gęstość mikrobiologiczną żołądka szacuje się na poziomie 10-1000 jtk/g – niskie pH nie sprzyja wzrostowi drobnoustrojów). Jelito cienkie zasiedlają: Clostridium spp., Lactobacilles i Proteobacteria, podczas gdy w okrężnicy dominują Clostridiales, Bacteroides spp., Prevotella i Fusobacteria. Grzyby i wirusy są również istotnymi składowymi bioty, ale ich rola w utrzymaniu zdrowia zwierzęcia wciąż jest badana (grzyby stanowią 2% komórek bioty w kale, średnio 40 różnych filotypów). W badaniach bioty fekalnej w próbkach od zdrowych psów dominują: Fusobacterium, Bacteroidetes oraz Firmicutes. Co ciekawe, u ludzi Fusobacterium są wiązane ze stanami chorobowymi jelit, zatem prawdopodobnie te bakterie odgrywają inną rolę u ludzi i u psów. Wyższe poziomy Fusobacterium są odnotowywane u wszystkich mięsożernych.
„Żywią i bronią”
Spośród gatunków bakterii jelitowych możemy wyróżnić te, które zdecydowanie dają korzystne efekty organizmowi gospodarza, oraz te, które chciałyby tylko skorzystać ze środowiska gospodarza – „szkodliwe”. Pamiętajmy, że mamy do czynienia z bakteriami mutualistycznymi, ale także bakterie dostarczane są wraz z pokarmem (zwłaszcza niepoddanym obróbce termicznej lub nieprawidłowo przetworzonym/przechowywanym) bądź w przypadku infekcji różnymi drogami, mogą docierać do przewodu pokarmowego wraz z krwią.
Wykazano, że biota jelitowa nie tylko warunkuje ciągłość i integralność nabłonka jelitowego (chroniąc jelito przed tzw. przeciekaniem, ang. leaky gut), stymuluje tempo proliferacji enterocytów, poprawia perystaltykę i wchłanianie składników pokarmowych, lecz także zapewnia homeostazę układu immunologicznego, chroniąc organizm gospodarza przed niekorzystnym działaniem bakterii chorobotwórczych, m.in. Salmonella spp., Shigella spp., Campylobacter jejuni, Yersinia enterocolitica czy Listeria monocytogenes. Bakterie komensale stymulują wytwarzanie przeciwciał sekrecyjnych sIgA oraz antybakteryjnych kationowych peptydów CAMPs (ang. cationic antimicrobial peptides). Jednym z najpowszechniej uznawanych mechanizmów ochronnych jest oczywiście zasiedlenie niszy ekologicznej – co kompetycyjnie utrudnia bakteriom patogennym dotarcie do warstwy nabłonka jelita. Kompetycja to także blokowanie receptorów niezbędnych do adhezji. Na przykład Lactobacillus plantarum (często obecny w preparatach probiotycznych) korzysta z tych samych receptorów mannozowych, co enetropatogenne szczepy E. coli.
Bakterie mikrobiomu produkują bakteriocyny – substancje o aktywności przeciwbakteryjnej. Dostarczają organizmowi gospodarza witaminy K, B1, B6, B12 oraz kwas foliowy, biota jest także odpowiedzialna za absorpcję jonów magnezu, wapnia i żelaza. Jednocześnie konkuruje z patogenami o składniki pokarmowe. W badaniach wykryto, że zmiany w składzie węglowodanów dostępnych w przewodzie pokarmowym są zależne od składu bioty i można je powiązać z podatnością na infekcje.
Niektóre bakterie Bacteroides stymulują organizm gospodarza do wytwarzania niezbędnych dla nich składników pokarmowych, np. fukozy czy tryptofanu. Postbiotyk wytwarzany przez biotę – maślan jest preferowanym źródłem energii dla komórek jelita grubego. Obecność maślanu stymuluje wytwarzanie peptydu katelicydyny o właściwościach przeciwbakteryjnych – jest to też forma samozabezpieczenia przed nadmiernym rozrostem bioty jelitowej, co pomaga w zachowaniu homeostazy. Maślan może hamować ekspresję genów odpowiedzialnych za inwazyjność szczepów Salmonella Typhimurium. Bakterie z rodzajów Lactobacillus oraz Bifidobacterium mogą zapobiegać infekcjom wywoływanym przez listerię. Produkowany przez Lactobacillus kwas mlekowy hamuje wzrost wielu bakterii chorobotwórczych oraz współuczestniczy w uszkadzaniu błony bakteryjnej. Peptydoglikan (mDAP) bakterii gram-ujemnych aktywuje neutrofile do walki z patogenami, takimi jak gronkowce czy paciorkowce.
Odporność i zdrowie
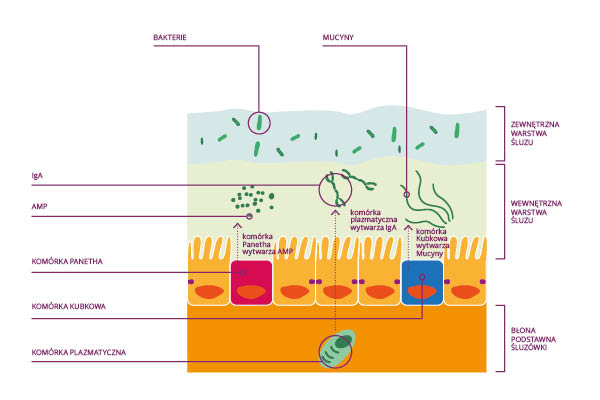
Okazuje się, że w wielu aspektach organizm gospodarza jest wręcz uzależniony od prawidłowej bioty jelitowej. Biota ma zdolność regulacji ekspresji genów w organizmie gospodarza, zwłaszcza genów odpowiedzialnych za przyswajanie węglowodanów i tłuszczów (inna biota występuje u osobników szczupłych i otyłych). Układ immunologiczny jelita (GALT) wytworzył wiele mechanizmów, które uczestniczą w utrzymaniu areaktywności w stosunku do jelitowych komensali, np. rozpoznawanie antygenów bakteryjnych hamowane jest przez warstwę śluzu (w jelicie grubym dwie warstwy) znajdującą się na powierzchni nabłonka jelita. Śluz wytwarzany jest przez komórki kubkowe, a ważnym jego składnikiem jest mucyna (nieaktywny gen mucyny MUC2 sprzyja stanom zapalnym jelit). Komórki Panetha w kryptach jelitowych wytwarzają białka defensyny (cryprtydyny) i lektyny, które są białkami antybakteryjnymi (AMP-ang. antimicrobial peptieds) i odgrywają rolę w ograniczeniu translokacji bioty jelitowej ze światła jelita do węzłów chłonnych kreskowych.
Co ciekawe, biota, żeby uniknąć zwalczania przez układ odpornościowy gospodarza, wykształciła wiele przystosowań umożliwiających przetrwanie i skolonizowanie jelit. W tym np. hamowanie sygnału stymulującego wytwarzanie lektyny i defensyn – przez aktywację receptorów TRL oraz NOD2 (inne mechanizmy: obniżanie ekspresji genów odpowiedzialnych za zwalczanie bakterii Gram +; a niektóre enterokoki indukują ekspresję genów odpowiedzialnych za wytwarzanie interleukiny-10, mającej działanie przeciwzapalne). Wytwarzanie AMP jest uzależnione od rodzaju bakterii występujących w jelicie. Przez eliminację drobnoustrojów AMP-wrażliwych zachodzi zjawisko określane jako „samoregulacja bakterii”. Swoiste właściwości GALT powodują, że bakterie komensale i niepatogenne nie indukują odpowiedzi zapalnej, nawet jeśli nastąpi ich translokacja poza światło jelita. Prezentacja bakterii komensalnych generuje tzw. ochroną odpowiedź immunologiczną (wytwarzanie IgA oraz IL-10). Natomiast wywołanie odpowiedzi immunologicznej przez bakterie patogenne wiąże się z ich wirulencją umiejscowioną w genomie w obrębie tzw. wysp patogenności (ang. PAI pathogenity Island) przejawiającej się zdolnością inwazji i przeżycia w tkankach gospodarza. Wyspy patogenności opisano u E. coli, Yersinia spp., Salmonella spp., Shigella spp. czy Helicobacter pylori.
dr Karolina Niezabitowska
Brand Manager
www.vetexpert.eu
Przyczyny zjadania odchodów – nazywanego koprofagią, ą są trudne do zidentyfikowania. Najczęściej wynikają z zaburzeń trawienia i naturalnej mikroflory bakteryjnej. Koprofagia może być niebezpieczna dla zdrowia pupila i domowników, np. ze względu na inwazje pasożytnicze. Dlatego polecam CoproVet, ponieważ to jedyny preparat na rynku o tak bogatym składzie i wielokierunkowym działaniu: poprawia trawienie, uzupełnia i stymuluje odbudowę naturalnej ochronnej flory bakteryjnej oraz ogranicza nieprzyjemny zapach.
Równowaga chwiejna
Całość interakcji mikrobiom – gospodarz można nazwać pojęciem z zakresu fizyki – równowagą chwiejną. Każde gwałtowne zmiany w profilu bioty, czyli dysbiozy, mogą wiązać się z wystąpieniem niekorzystnych objawów u gospodarza czy wręcz chorób (w tym alergii). Wydaje się, że np. zwiększona liczba bakterii Gram-ujemnych, które przez obecność ściany lipopolisacharydowej silniej oddziałują na układ immunologiczny, może się przyczyniać do stanów zapalnych jelit. W dyzbiozie ogólnie u ludzi i u psów stwierdza się zwiększoną liczbę bakterii z rodziny Enterobacteriaceae.
Zagrożenia dla mikrobioty
Jednym z najistotniejszych czynników prowadzących do dysbiozy jest terapia antybiotykowa (inne to dieta – dieta „zachodnia” zmniejsza poziom Bacteroidetes, stres, zmiany w funkcjonowaniu układu odpornościowego). Przy terapii doustnej biota jest wystawiona na działanie wysokich stężeń antybiotyków – co prawda nie prowadzi to do całkowitego wyjałowienia przewodu pokarmowego, jednak struktura gatunkowa mikrobiomu może zostać zmieniona. Może to prowadzić do wzdęć, biegunek poantybiotykowych, zaburzeń metabolicznych, zmniejszenia wchłaniania witamin itd. Szczególnie wrażliwe na antybiotyki są bakterie Firmicutes, kolejne to Bacteroidetes, zaś udział Proteobacteria może gwałtownie wzrastać. U ludzi leczonych antybiotykami stwierdzano większą podatność na zakażenia: Salmonella enterica, patogennymi szczepami E. coli, a przede wszystkim Clostridium difficile. Zwraca się też uwagę, że antybiotykoterapia zmniejsza w przewodzie pokarmowym udział bakterii wrażliwych na ten antybiotyk, co powoduje zwolnienie niszy ekologicznej, która może być zasiedlona przez szczepy oporne i utrzymanie mechanizmów warunkujących oporność (geny – w przewodzie pokarmowym panują idealne warunki do wymiany materiału genetycznego między współbytującymi szczepami). U psów oprócz antybiotykoterapii należy brać pod uwagę wpływ środków odrobaczających na równowagę bioty.
Istotne jest zatem, aby nie stosować nadmiernie antybiotykoterapii, a także wspomagać „dobre” bakterie jelitowe przez podawanie żywych kultur bakterii (preparaty probiotyczne lub synbiotyki). Takie kultury warto również stosować, kiedy chcemy pobudzić układ immunologiczny – poprawić odporność.
Dieta to podstawa!
Z najnowszych doniesień naukowców amerykańskich (Uniwersytet Stanowy San Diego) wynika, że przez odpowiednią dietę można stymulować produkcję bakteriofagów (wirusów atakujących bakterie) i przez to kształtować biotę jelitową, eliminując szkodliwe bakterie. Wyróżniono 28 czynników stymulujących fagi (spośród 117 powszechnie spożywanych produktów żywnościowych, ekstraktów i dodatków do żywności), w tym: propolis, stewię, oregano, cynamon, goździki, granat, rabarbar, mącznicę lekarską i ekstrakt z miodli indyjskiej (neem).
U psów prowadzono badania nad wpływem diety na profil bioty. Porównywano komercyjne diety tzw. suche, ekstrudowane (w których zawartość włókna jest wysoka) z dietą BARF (większa zawartość tłuszczu i białka, mniejsza włókna i węglowodanów rozpuszczalnych). U psów na diecie BARF stwierdzono spadek w liczbie bakterii z gromady Firmicutes (Peptostertococcus, Faecalibacterium) i Bacteroidetes (Prevotella, Bacteroides), które są odpowiedzialne za fermentację włókna i produkcję SCFA. Natomiast wzrosła liczba bakterii Fusobacterium, Lactobacillus i Clostridium (u psów Clostridiaceae wiąże się to z metabolizmem białka w przewodzie pokarmowym oraz produkcją maślanu z protein).
Również w Stanach Zjednoczonych opracowano dla psów algorytm oparty na badaniach techniką PCR, nazwany „Dysbiosis Index”, który pomoże lekarzom weterynarii ocenić stopień dyzbiozy, monitorować stany chorobowe i odpowiedź na leczenie.