Mikrobiom to specyficzny i unikatowy dla każdego makroorganizmu (zwierzęcia czy człowieka) zespół drobnoustrojów oraz ich genów, których zmienność zależy od wielu czynników, w tym środowiska, diety czy stanu fizjologicznego organizmu. Zmienność jest dość duża, ale najważniejsze jest utrzymanie dynamicznej równowagi między mikrobiomem a żywicielem. Mikrobiom nie jest jednolity, jego skład jest zróżnicowany zależnie od lokalizacji, stąd mówi się o mikrobiomie skóry, błon śluzowych (m.in. jamy nosowej i ustnej). Mikrobiom przewodu pokarmowego jest najliczniejszym i najbogatszym liczebnością gatunków – u człowieka masa tworzących go drobnoustrojów może sięgać nawet dwóch kilogramów. Mikrobiom przewodu pokarmowego zasiedla cztery przedziały (jamę ustną, żołądek oraz jelita cienkie i grube) o różnych warunkach środowiskowych pod względem zasobności w tlen, odczynu, motoryki itp., stąd też wykazuje znaczne różnice w składzie ilościowym i jakościowym zamieszkujących mikroorganizmów. Temat mikrobiomu jelitowego i jego roli w utrzymaniu funkcji układu pokarmowego oraz wpływu na odporność jest dość dobrze poznany. Co więcej, okazuje się, że może on oddziaływać również na inne narządy organizmu żywiciela, jednym z nich jest mózg.
Tekst: dr Joanna Zarzyńska1, prof. dr hab. Romuald Zabielski2
1Katedra Higieny Żywności i Ochrony Zdrowia Publicznego,
Instytut Medycyny Weterynaryjnej SGGW w Warszawie
2Centrum Medycyny Translacyjnej SGGW w Warszawie
Czym jest mikrobiom jelitowy?
Mikrobiom jelitowy, wcześniej nazywany mikroflorą jelitową, jest często w literaturze określany jako nowo odkryty narząd (czy też zapomniany narząd). W skład mikrobiomu jelitowego wchodzą bakterie, wirusy, grzyby i archeony, z czego bakterie stanowią około 95%. Liczba identyfikowanych gatunków bakterii gwałtownie powiększyła się dzięki postępom w diagnostyce molekularnej (głównie dzięki sekwencjonowaniu 16s rRNA bądź całego genomu). Obecnie mówi się o 17 rodzinach, 50 rodzajach i ponad 1000 gatunkach. Wcześniej, zanim zastosowano techniki molekularne, hodowano na pożywkach mniej niż 1/10 obecnie identyfikowanych gatunków bakterii. W badaniach genomu mikrobioty jelitowej stwierdzono znaczny udział genów, które nie występują w genomie człowieka/ zwierząt (metagenom). Produkty tych genów biorą udział w metabolizmie związków nierozkładanych przez gospodarza (jak np. niektóre węglowodany, aminokwasy, ksenobiotyki) oraz syntezie witamin.
Liczba bakterii oraz ich skład gatunkowy różnią się w zależności od odcinka przewodu pokarmowego. Indywidualny mikrobiom jelitowy danej osoby jest unikatowy (tak jak linie papilarne) i zmienny. Podobnie jest u zwierząt. Jedynie ok. 1% składu bakterii jest mało zmienny i tworzy tzw. rdzeń mikrobiomu (ang. core microbiome). Zmienność odnotowuje się zarówno u noworodków, jak i u dorosłych osobników, a mają na to wpływ czynniki genetyczne, wiek, płeć, dieta, stres, przebyte infekcje, higieniczne warunki środowiskowe, antybiotykoterapia. U psów istotnym źródłem zmienności są rasa i wielkość zwierzęcia. W warunkach fizjologicznych przewód pokarmowy płodów szczeniąt i kociąt jest sterylny, ale podczas porodu i wędrówki przez kanał rodny otrzymują od matki „pierwszą wyprawkę” w postaci przedstawicielstwa mikrobiomu błon śluzowych pochwy. „Drugą wyprawkę” stanowi mikrobiom jamy ustnej naniesiony na noworodka w czasie jego wylizywania przez matkę oraz mikrobiom skóry okolicy sutków podczas ssania siary. W międzyczasie „wyprawki” te są wzbogacane o mikroorganizmy z najbliższego środowiska. Budowanie mikrobiomu noworodka odbywa się na zasadzie „kto pierwszy, ten lepszy”, stąd niezwykle ważne jest, aby matka i najbliższe środowisko dostarczyły noworodkowi wyłącznie pożądane drobnoustroje. Brak w jelicie określonych drobnoustrojów na wczesnym etapie życia (np. jako efekt porodu poprzez cesarskie cięcie, brak fizycznego kontaktu i ssania matki) może skutkować poważnymi konsekwencjami, np. nadmierną reaktywnością na stres. W jelicie cienkim człowieka występują głównie bakterie względnie beztlenowe i tlenowe (np. Lactobacillus spp., Enterococcus, Staphylococcus, Bifidobacterium), a w okrężnicy dominują bezwzględne beztlenowce (Bacteroidetes i Firmicutes, które obejmują grupy: Clostridium, Ruminococcus spp., Faecalibacterium spp. oraz Dorea spp.). U dorosłego psa w jelicie cienkim stwierdzono 102-105 jtk/g treści (w jelicie krętym nawet do 109 jtk/g treści), natomiast w okrężnicy 108-1011 jtk/g. Większość, bo aż 99% bioty jelitowej psów i kotów, stanowią Firmicutes, Bacteroidetes, Proteobacteria, Fusobacteria. W żołądku stwierdzane są Helicobacter spp., Actionobacillus i Streptococcus spp. Jelito cienkie zasiedlają Clostridium spp., Lactobacilles i Proteobacteria, podczas gdy w okrężnicy dominują Clostridiales, Bacteroides spp., Prevotella i Fusobacteria. Mikrobiom zdrowych psów jest zdominowany przez trzy typy: Firmicutes, Bacteroidetes i Fusobacterium. W ich obrębie wyróżnia się głównie Clostridia i Bacilli, natomiast liczebność Prevotella i Bacteroides jest bardzo zróżnicowana u różnie karmionych psów.
Rola mikrobiomu jelitowego
Mikrobiota kolonizuje – zasiedla niszę środowiskową przewodu pokarmowego i między szczepami drobnoustrojów a gospodarzem panuje mutualizm – każda ze stron czerpie korzyści. Mówiąc o zasiedlaniu, mamy tu na myśli ustalenie fizycznego kontaktu z receptorami na błonie wierzchołkowej enterocytu albo uwięźnięcie w siateczce śluzu osłaniającego nabłonek kosmków i krypt jelitowych. Część drobnoustrojów jest niesiona z treścią pokarmową i złuszczonym śluzem oraz nabłonkami (te ostatnie najkrócej przebywają w świetle jelita). Drobnoustroje tworzące mikrobiom stymulują regenerację błony śluzowej i zapewniają integralność nabłonka jelitowego oraz regulują perystaltykę jelit. Ponadto biorą udział w trawieniu i wchłanianiu składników pokarmu. Na przykład bakterie biorą udział w przetwarzaniu azotu i lipidów, modyfikują metabolizm cholesterolu oraz syntetyzują witaminy (B12, kwas foliowy, K i kwas pantotenowy). Wytwarzane podczas bakteryjnej fermentacji węglowodanów pokarmowych krótkołańcuchowe kwasy tłuszczowe (z ang. SCFA – kwas octowy, propionowy i masłowy) są istotnym substratem dla innych drobnoustrojów oraz komórek nabłonka jelitowego. Wśród nich na szczególne wyróżnienie zasługują bakterie butyrogenne, wytwarzające kwas masłowy, który jest istotnym dawcą energii niezbędnej do życia kolonocytów w okrężnicy (do 7% energii metabolicznej u psów jest wytwarzanej z fermentacji węglowodanów w okrężnicy). Ponadto kwas masłowy z jednej strony stymuluje proliferację zdrowych komórek nabłonka, a z drugiej pobudza apoptozę komórek nabłonka okrężnicy zmienionych nowotworowo (tzw. paradoks maślanu – butyrate paradox). Poza istotną rolą w procesach odnowy nabłonka kwas masłowy wykazuje działanie bakteriobójcze (wobec bakterii wrażliwych na niskie pH: E. coli, Clostridia spp., Salmonella spp., Listeria spp.) i przeciwzapalne, a także uczestniczy w regulacji uczucia sytości i pobudza aktywność motoryczną przewodu pokarmowego poprzez receptory dla SCFA. Szczególnie znaczenie w aspekcie zdrowia makroorganizmu mają przemiany pierwotnych kwasów tłuszczowych do wtórnych, które zachodzą przy udziale Clostridium hiranonis. Bakterie uczestniczą także w kształtowaniu nieswoistych mechanizmów odpornościowych. Zwiększają aktywność przeciwciał, a także syntetyzują neurotransmitery.
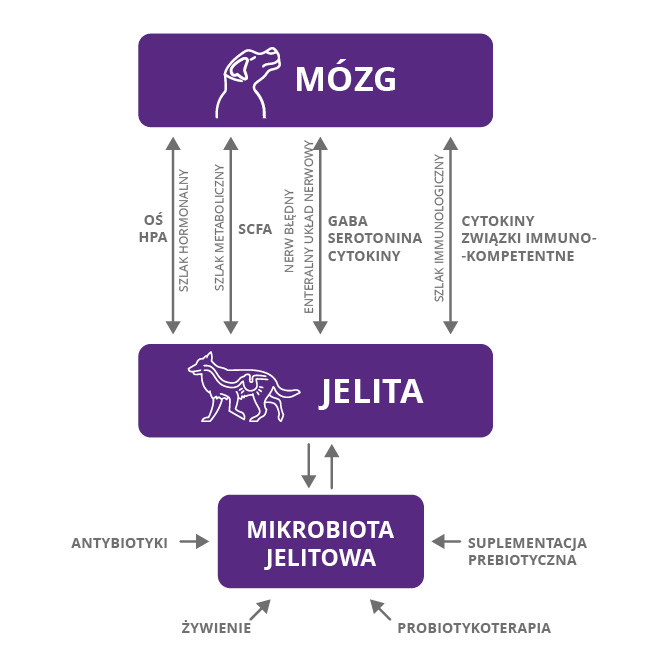
Oś mózgowo-jelitowa
Doktor Gershon z Columbia University Medical Center jest twórcą pojęcia „mózg jelitowy”. Badacz zauważył, że w ścianie jelita są zlokalizowane neurony uporządkowane w struktury nerwowe (zwoje podśluzówkowe i międzymięśniowe oraz liczne wolne zakończenia nerwowe) w liczbie znacznie przekraczającej tę w rdzeniu kręgowym. Ten swoisty układ nerwowy jelita (ang. enteric nervous system, ENS), mimo że jest zintegrowany z centralnym układem nerwowym poprzez autonomiczne unerwienie współczulne i przywspółczulne, posiada sporą dozę autonomii. Dla podkreślenia rangi komunikacji ENS z ośrodkowym układem nerwowym w regulacji pobierania pokarmu i funkcji trawiennych struktury składowe określono terminem „oś mózgowo-jelitowa” (ang. Brain-Gut Axis). Nowsze badania donoszą o oddziaływaniach drobnoustrojów mikrobiomu jelitowego z zakończeniami nerwowymi ENS bezpośrednio albo za pośrednictwem komórek nabłonka. Zatem bakterie w jelicie tworzą skomplikowaną wspólnotę, komunikując się między sobą, wymieniając substratami i konkurując o możliwość skolonizowania komórek nabłonka, wchodzą także w interakcje z komórkami gospodarza, tworząc wielokierunkową sieć powiązań mikrobiom – żywiciel i aktywny ekosystem decydujący o zdrowiu czy chorobie (zarówno własnej, jak i gospodarza). Część interakcji między mikrobiomem jelitowym a komórkami żywiciela dociera echem do centralnego układu nerwowego za sprawą osi mózgowo-jelitowej. Komunikacja mikrobiomu z mózgiem poprzez oś mózgowo-jelitową jest obustronna i może się odbywać na kilku płaszczyznach: neuronalnej (poprzez ENS i nerw błędny), endokrynnej (poprzez komórki endokrynne jelita), metabolicznej (metabolizm błony śluzowej jelita), immunologicznej (poprzez komórki immunologiczne błony śluzowej jelita). Jednym z czynników regulujących na drodze endokrynnej jest kortyzol, jego wydzielanie jest regulowane przez oś podwzgórze – przysadka – nadnercza (HPA), a uwalniany jest pod wpływem stresu. Kortyzol wpływa na modulowanie aktywności i składu mirobioty oraz uwalnianie cytokin. Stąd np. długotrwały stres wywiera niekorzystny wpływ na funkcjonowanie jelit (motorykę, regenerację nabłonka itp.), ale też może doprowadzić do zwiększenia ilości niepożądanych drobnoustrojów, np. z rodzaju Clostridium. Z praktycznego punktu widzenia warto zatem, aby np. terapia behawioralna u psów z zaburzeniami zachowania była łączona z dietoterapią. Reakcja osi HPA na ostry stres może być łagodzona przez suplementację probiotykami.
W jaki sposób mikrobiom jelita może oddziaływać na oś mózgowo-jelitową?
Najkrócej mówiąc, za pośrednictwem wydzielanych przez poszczególne drobnoustroje metabolitów, które mogą oddziaływać jako substancja sygnalna (np. kwas masłowy), substrat/ prekursor neuroprzekaźników (np. tryptofan), neuroprzekaźnik (np. serotonina, u ludzi aż 90% serotoniny produkowanej jest w układzie pokarmowym głównie przez komórki enterochromafinowe) albo stymulować uwalnianie licznych neuromediatorów/ mediatorów przez zakończenia nerwowe i komórki nabłonka, w tym także komórki układu immunologicznego jelita. Wszystkie te metabolity mogą po uwolnieniu drażnić swoiste receptory na zakończeniach nerwowych neuronów aferentnych i tą drogą informacja ze światła jelita dociera do mózgu. Nerw błędny (X nerw czaszkowy) stanowi główną drogę aferentną od jamy brzusznej do mózgu i również wskazuje się, że mikrobiom może poprzez jego aktywowanie wpływać na działanie mózgu na poziomie fizjologicznym i behawioralnym.
Wpływ mikroorganizmów jelitowych na mózg wykazano nie tylko na poziomie funkcjonalnym, lecz także strukturalnym – np. metabolity bakteryjne zmieniały tempo mielinizacji (tworzenia osłonek włókien nerwowych) w korze mózgowej myszy.
Istotnym pośrednikiem w komunikacji jelito – mózg jest także GALT (ang. gut-associated lymphoid tissue), czyli tkanka limfatyczna przewodu pokarmowego i wydzielane przez nią cytokiny będące mediatorami reakcji zapalnych. Komórki układu odpornościowego w większości zgromadzone w kępkach Peyera, także komórki dendrytyczne umiejscowione tuż pod powierzchnią nabłonka jelitowego, posiadają wypustki sięgające światła jelita, przez co kontaktują się z mikroorganizmami. Dla prawidłowego funkcjonowania GALT istotne znaczenie ma integralność nabłonka jelitowego, stanowiącego fizyczną barierę chroniącą przed naporem drobnoustrojów. Przy zaburzeniach integralności nabłonka antygeny bakteryjne przekraczają barierę i zwiększają ekspozycję w tkance limfatycznej i surowicy krwi, co powoduje produkcję cytokin prozapalnych (TNF-α, IFN-gamma, IL-6). U psów GALT jest w 90% odpowiedzialny za odporność na poziomie jelita!
Badania nad interakcjami mikrobiota – mózg prowadzono głównie na gryzoniach i świniach w kontekście fizjologii człowieka. Ze względu na strukturalne podobieństwo bariery jelitowej i bariery krew – mózg (ang. blood-brain barier, BBB) w badaniach na myszach pozbawionych mikrobioty (germ free) wykazano zmiany w przepuszczalności BBB i bariery jelitowej – np. normalizowanie przepuszczalności dzięki kolonizacji bakteriami wytwarzającymi SCFA. W badaniach na myszach wykazano także, że zwierzęta germ free mają obniżony poziom serotoniny w surowicy krwi i jelicie. A zachowania lękowe można wywołać poprzez przeszczepienie mikrobioty od zwierzęcia wykazującego lęk.
Tryptofan należy do grupy aminokwasów niezbędnych i jest prekursorem serotoniny. Może być metabolizowany w trzech różnych ścieżkach (synteza serotoniny, kinureniny oraz indolu), wpływając na samopoczucie. Szlak kinureninowy jest głównym szlakiem metabolicznym, a pod wpływem stresu dodatkowo ograniczana jest produkcja serotoniny. Kinurenina w mózgu jest przekształcana do kwasu chinolinowego – neurotoksycznego lub kwasy kynurenowego – neuroproteksyjnego. Na modelu zwierzęcym wykazano też, że długotrwały stres i zwiększenie produkcji cytokin prozapalnych mogą zwiększyć liczbę bakterii metabolizujących tryptofan do indolu i obniżyć biodostępność tryptofanu dla gospodarza.
Obecnie również u psów wiąże się mikrobiotę jelitową z zaburzeniami zachowania – np. występowaniem agresji (neurotransmitery produkowane przez mikrobiom są powiązane z osią serotoninową). Wykazano różnicę między profilem mikrobioty psów agresywnych i psów stabilnych.
Jak już wspomniano, kluczowym czynnikiem w funkcjonowaniu osi mózgowo-jelitowej jest sprawność bariery jelitowej. Na jej integralność może wpływać wiele czynników, np. działanie bodźców stresowych, nadmierna ilość kortyzolu we krwi, niedobory składników pokarmowych, ksenobiotyki. Zmiana przepuszczalności bariery jelitowej może być też efektem dysbiozy, czyli zmiany równowagi w mikrobiomie poprzez zmianę składu i różnorodności gatunków drobnoustrojów, przy zbyt małej liczbie tzw. dobrych bakterii chroniących, a namnażaniu się bakterii i grzybów potencjalnie patogennych. Przyczynami dysbiozy mogą być nieodpowiednia dieta, długotrwałe stosowanie antybiotyków czy leków przeciwzapalnych. U psów opisano dysbiozę w przypadku inwazji Giardia duodenalis. Zarówno u zwierząt, jak i u ludzi powiązano dysbiozę z ostrymi bądź chronicznymi schorzeniami przewodu pokarmowego (np. choroba zapalna jelit, IBD, zespół jelita drażliwego, IBS), a pacjenci na nie cierpiący często zmagają się również z problemami depresji czy stanami lękowymi. Do oceny dysbiozy wykonuje się tzw. indeks dysbiotyczny metodą PCR, ale także badanie surowicy krwi (zawartość folianów, kobalaminy, SCFA czy niezwiązanych kwasów żółciowych). W badaniach na modelu zwierzęcym w warunkach chronicznego stresu zaobserwowano zmniejszenie liczebności bakterii Firmicutes i Bacteroidetes, a u ludzi z depresją nadreprezentację rzędu Bacteroidales.
Psychobiotyki
W badaniach naukowych wykazano, że przewlekłe stany zapalne jelit oraz nieprawidłowe funkcjonowanie bariery jelitowej mają wpływ na powstawanie chorób układu nerwowego, takich jak depresja, lęki czy zaburzenia równowagi emocjonalnej. Wykazano powiązania zmian w mikrobiocie jelitowej u dzieci ze spektrum autyzmu, przy chorobach neurozwyrodnieniowych i neuroimmunologicznych, przy zwiększonej podatności na stres, u osób z napadami paniki, a także u osób cierpiących na depresję oraz chorobę afektywną dwubiegunową.
W przypadku dysbiozy i zaburzeń równowagi bioty jelitowej od pewnego czasu rutynowo stosuje się suplementację probiotykami. Są to wyselekcjonowane gatunki i szczepy bakterii (pożądane w mikrobiomie jelitowym), które są zdolne do kolonizacji jelit i, podane w odpowiedniej ilości, wywołują wielokierunkowe, korzystne efekty dla organizmu gospodarza. Mają one potwierdzone naukowo działanie. Część z nich (np. bakterie kwasu mlekowego) konkurują z patogenami (np. z salmonellami) o miejsca wiązania na komórkach nabłonka, co utrudnia im adherencję i kolonizację. Do korzystnych efektów zalicza się wzmacnianie integralności nabłonka jelitowego (stymulacja proliferacji komórek nabłonka i wytwarzania mucyny, produkcja postbiotyków – np. maślanu i innych SCFA). Ten aspekt odbudowywania bariery jelitowej jest ważny dla osi mózgowo-jelitowej. Psychobiotyki to wyodrębniona grupa probiotyków. Termin „psychobiotyki” sformułowali w 2013 roku dwaj naukowcy, Ted Dinan (psychiatra) oraz John F. Cryan (neurolog). Dzięki osiągnięciom badań w dziedzinie neuronauki zaobserwowano, że niektóre gatunki bakterii probiotycznych szczególnie korzystnie oddziałują na oś mózgowo-jelitową np. poprzez receptory GABA na zakończeniach aferentnych nerwu błędnego, obniżając poziom kortyzolu we krwi. Mogą mieć znaczący wpływ na nastrój oraz funkcje poznawcze, poprawiać pamięć, mogą także zmniejszyć objawy lęku i obniżyć reaktywność na stres. Nerw błędny uważany jest za kluczowy element pośredniczący we wpływie mikrobioty na zachowanie, m.in. obserwowanego negatywnego efektu przewlekłych stanów zapalnych jelit na układ nerwowy. Wagotomia (czyli przecięcie nerwu błędnego) blokuje przeciwlękowe (anksjolityczne) działanie Bifidobacterium longum, jak i antydepresyjne działanie Lactobacillus rhamnosus.
Szczepy Lactobacillus oraz B. infantis są szczególnie wskazywane jako te, które mają zdolności normalizowania zachowań o podłożu stresowym. Do grupy psychobiotycznych zalicza się szczepy bakterii Lactobacillus hevelticus, Bifidobacterium longum, Bifidobacterium infantis, Lactobacillus reuteri, Lactobacillus acidophillus i Lactobacillus rhamnosus. Te gatunki były już wcześniej znane ze swojego działania probiotycznego, a wymienione nazwy mogą się kojarzyć choćby z mlecznymi napojami fermentowanymi. Psychobiotyki mogą wpływać na odpowiedź stresową osi podwzgórze – przysadka – nadnercza (HPA) bądź bezpośrednio na układ immunologiczny albo poprzez wydzielanie neuroprzekaźników czy SCFA (głównie kwasu masłowego). Wykazano u ludzi, że preparaty ze szczepami L. helveticus, L. plantarum i B. longum przyczyniały się do zmniejszenia odpowiedzi ze strony HPA i obniżenia stężenia kortyzolu. W stanie dysbiozy obserwuje się też obniżone stężenie BDFN (neurotroficznego czynnika pochodzenia mózgowego, brain-derived neurotrophic factor), które wywołuje zaburzenia nastroju. Wykazano pozytywny wpływ bakterii z rodzaju Bifidobacterium oraz L. helveticus oraz prebiotyków (FOS i GOS) na wzrost poziomu BDFN w hipokampie. Zaburzona regulacja osi HPA może wpływać na zmniejszenie ekspresji BDFN poprzez nasilenie apoptozy komórek układu nerwowego i zmniejszając neuroplastyczność. Należy tu podkreślić szczególnie korzystną rolę protekcyjną B. infantis.
Z kolei szczep Lactobacillus rhamnosus GG wpływa na wzrost stężenia IL-10 działającej przeciwzapalnie. A u osób z depresją często obserwuje się wzrost występowania markerów prozapalnych, jak IL-6, TNF- alfa i białko CRP. Cytokiny IL-1 i IL-6 aktywują oś HPA i zwiększają wydzielanie kortyzolu. Stąd IL-10 jest wykorzystywana w terapii depresji do ograniczania procesów zapalnych.
SCFA mogą również bezpośrednio wpływać na funkcjonowanie układu nerwowego, głównie poprzez wzmacnianie integralności bariery krew – mózg, a także uczestniczyć w procesie konsolidacji pamięci i przekazywaniu sygnałów nerwowych, regulując uwalnianie i produkcję neuroprzekaźników. Wpływają też na aktywność komórek odpornościowych, w tym mikrogleju, co ma znaczenie w przypadku depresji – zwiększenie aktywacji układu immunologicznego może prowadzić do rozwoju depresji głównie poprzez zmniejszanie dostępności kluczowych aminokwasów tryptofanu i tyrozyny, które są niezbędne do wytwarzania melatoniny, serotoniny (hormonu szczęścia) i dopaminy.
Rodzina Bacillus zwiększa wytwarzanie dopaminy i noradrenaliny, Bifidobacterium zwiększa produkcję GABA, Enterococcus stymuluje uwalnianie serotoniny, bakterie z rodziny Escherichia zwiększają uwalnianie serotoniny i noradrenaliny, zaś bakterie z gatunku Clostridium zwiększają stężenie wolnej dopaminy i noradrenaliny (neuroprzekaźników katecholaminowych), które pozytywnie wpływają na procesy uczenia się i pamięci.
Właściwości psychobiotyczne są specyficzne dla danego szczepu. W preparatach dla ludzi często stosuje się kombinacje szczepów oraz synbiotyki. W ostatnich latach liczne odkrycia dotyczące właściwości i zastosowania psychobiotyków w praktyce psychiatrycznej spowodowały, że ich definicja została rozszerzona o uwzględnienie nie tylko żywych mikroorganizmów, lecz także ich substratów i metabolitów, które oddziałując na mikrobiom, mogą przynieść korzyści zdrowotne pacjentom z chorobami psychicznymi lub neurologicznymi. Wedle aktualnej wiedzy u ludzi nie ma przeciwskazań do stosowania psychobiotyków. W terapii ludzi wykorzystuje się także nie tylko same suplementy diety zawierające kombinacje bakterii probiotycznych, czy ich produktów (np. kwas masłowy), lecz także żywność funkcjonalną, dlatego na rynek wprowadzono produkty fermentowane z zastosowaniem kultur psychobiotycznych – np. jogurty. Dla wegetarian wyjściowym surowcem do fermentacji jest białko sojowe.
Zastosowanie psychobiotyków u psów
Badania przeprowadzone na psach potwierdzają zmiany w mikrobiomie między psami agresywnymi, psami z fobiami a zwierzętami zachowującymi się normalnie. W związku z tym rozważa się użycie psychobiotyków do oddziaływania na oś mózgowo-jelitową na poziomie jelit, które mogłoby poprawić funkcjonowanie mózgu. Pojawiają się pierwsze preparaty z psychobiotykami dla psów. Między innymi zawierające Bifidobacterium longum o potwierdzonym już działaniu u ludzi – jak poprawa jakości snu, obniżanie poziomu lęku i stresu, poprawa zdolności poznawczych u osób z chorobą Alzheimera. Szczep ten pojawia się w preparatach uspokajających dla psów (preparaty „calming”), a także w badaniach nad łagodzeniem współistniejących przy padaczce problemów behawioralnych u psów. Szczep Lactiplantibacillus plantarum wykorzystano w badaniu nad łagodzeniem agresji i lęku separacyjnego u psów. Badanie to wykazało, że 14-dniowe doustne podawanie szczepu L. plantarum PS128 stabilizowało ogólny stan emocjonalny psów i łagodziło nasilenie problemów behawioralnych.
Według WHO do roku 2030 depresja będzie najczęściej występującą chorobą u ludzi. Obecnie choruje na nią ok. 280 mln ludzi na świecie, w Polsce ponad milion. Zatem z pewnością badania nad psychobiotykami i nowymi preparatami z ich wykorzystaniem będą kontynuowane. Ale zaburzenia neurologiczne nie dotyczą tylko ludzi. Na świecie szacunkowo ok. 29% psów wykazuje oznaki lęku, a około 70% zaburzeń zachowania można przypisać jakiejś formie lęku. Można więc przewidywać, że prowadzone będą także dalsze badania nad zastosowaniem psychobiotyków u zwierząt w celu poprawy ich dobrostanu. Należy podkreślić, że wsparcie dietetyczne w postaci FOS i GOS również daje pozytywne efekty poprzez modulowanie składu mikrobioty.
Zaczęto się również zastanawiać nad rolą mikrobiomu skórnego i jego wpływem na zachowanie zwierząt, ponieważ chroniczny stres może ogrywać rolę w patogenezie chorób dermatologicznych. A stany zapalne zarówno przewodu pokarmowego, jak i skóry często wiążą się ze zmianami zachowania u zwierząt, np. nadmiernym wylizywaniem.